藥品注冊審評制度改革給藥品技術(shù)轉(zhuǎn)讓帶來的機遇與挑戰(zhàn)
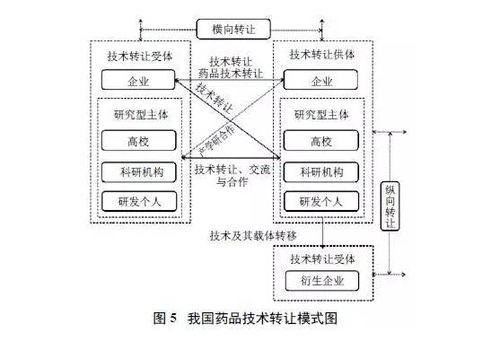
近年來,我國藥品注冊審評制度經(jīng)歷了深刻變革,這些改革不僅提升了藥品審評的效率和質(zhì)量,也為藥品技術(shù)轉(zhuǎn)讓領(lǐng)域帶來了新的發(fā)展機遇,同時伴隨著一系列挑戰(zhàn)。技術(shù)轉(zhuǎn)讓作為藥品生命周期中的重要環(huán)節(jié),其模式與路徑正受到政策的顯著影響。
一、機遇分析
藥品注冊審評制度的改革,尤其是優(yōu)先審評、附條件批準(zhǔn)等機制的引入,為技術(shù)轉(zhuǎn)讓提供了更快的市場準(zhǔn)入通道。企業(yè)可以通過技術(shù)轉(zhuǎn)讓,快速獲取已進(jìn)入審評流程的品種,縮短研發(fā)周期,降低前期投入風(fēng)險。例如,對于創(chuàng)新藥或臨床急需藥品,技術(shù)轉(zhuǎn)讓方可以利用審評加速政策,迅速實現(xiàn)產(chǎn)品上市,從而搶占市場先機。
改革推動了藥品全生命周期管理的理念,促使技術(shù)轉(zhuǎn)讓不再局限于早期研發(fā)階段,而是延伸至上市后優(yōu)化和再注冊環(huán)節(jié)。這為轉(zhuǎn)讓雙方提供了更多合作機會,如通過技術(shù)轉(zhuǎn)讓引入成熟品種進(jìn)行本土化生產(chǎn),或轉(zhuǎn)讓方利用受讓方的市場資源實現(xiàn)產(chǎn)品價值最大化。
審評制度的透明化和標(biāo)準(zhǔn)化降低了技術(shù)轉(zhuǎn)讓的信息不對稱風(fēng)險。統(tǒng)一的審評標(biāo)準(zhǔn)和公開的審評進(jìn)度,使轉(zhuǎn)讓雙方能更準(zhǔn)確地評估產(chǎn)品價值,促進(jìn)交易達(dá)成。同時,政策鼓勵創(chuàng)新和仿制藥并重,為技術(shù)轉(zhuǎn)讓在仿制藥、改良型新藥等領(lǐng)域的應(yīng)用創(chuàng)造了空間。
二、挑戰(zhàn)剖析
盡管機遇顯著,但藥品技術(shù)轉(zhuǎn)讓在改革背景下也面臨諸多挑戰(zhàn)。首要挑戰(zhàn)是政策環(huán)境的不確定性。審評制度持續(xù)優(yōu)化,相關(guān)法規(guī)頻繁更新,企業(yè)需不斷調(diào)整技術(shù)轉(zhuǎn)讓策略以應(yīng)對變化,這增加了合規(guī)成本和風(fēng)險。例如,對于轉(zhuǎn)讓方而言,若未能及時跟進(jìn)最新審評要求,可能導(dǎo)致技術(shù)價值被低估或交易失敗。
技術(shù)轉(zhuǎn)讓對雙方的專業(yè)能力要求更高。改革強調(diào)藥品的安全性、有效性和質(zhì)量可控性,轉(zhuǎn)讓方需提供更全面的技術(shù)資料,而受讓方必須具備相應(yīng)的審評應(yīng)對能力和生產(chǎn)質(zhì)量管理體系。缺乏專業(yè)團隊的企業(yè)可能在技術(shù)評估、資料準(zhǔn)備或后續(xù)審評中遇到障礙。
市場競爭加劇也是一大挑戰(zhàn)。隨著審評效率提升,更多企業(yè)涌入技術(shù)轉(zhuǎn)讓領(lǐng)域,導(dǎo)致優(yōu)質(zhì)品種資源稀缺,轉(zhuǎn)讓成本上升。同時,受讓方在接收技術(shù)后,還需應(yīng)對激烈的市場競品和價格壓力,這要求技術(shù)轉(zhuǎn)讓不僅關(guān)注審評環(huán)節(jié),還需統(tǒng)籌市場策略。
三、應(yīng)對策略與展望
為把握機遇、應(yīng)對挑戰(zhàn),企業(yè)應(yīng)積極適應(yīng)政策變化,加強技術(shù)轉(zhuǎn)讓的全流程管理。建立專業(yè)團隊,跟蹤審評動態(tài),確保技術(shù)資料符合最新標(biāo)準(zhǔn)。注重知識產(chǎn)權(quán)保護(hù),在轉(zhuǎn)讓協(xié)議中明確權(quán)利和義務(wù),防范潛在糾紛。同時,可通過合作創(chuàng)新模式,如產(chǎn)學(xué)研結(jié)合,提升技術(shù)轉(zhuǎn)讓的附加值。
隨著藥品注冊審評制度進(jìn)一步優(yōu)化,技術(shù)轉(zhuǎn)讓有望在促進(jìn)藥品可及性和產(chǎn)業(yè)升級中發(fā)揮更大作用。企業(yè)需以創(chuàng)新驅(qū)動為核心,靈活運用技術(shù)轉(zhuǎn)讓工具,在變革中尋求可持續(xù)發(fā)展。
如若轉(zhuǎn)載,請注明出處:http://www.cdxsxj.com/product/20.html
更新時間:2026-01-21 19:38:43